|
РЕПЕТИТОР
ПО ХИМИИ
·
Репетитор
по химии Богунова В.Г.
·
Авторские
учебные материалы
·
Авторские
материалы
мультимедиа
·
Решение
задач по химии

Изучаем
Х-ОбХ-13
Растворы
·
Избранные главы конспектов
·
Ключевые алгоритмы задач
·
Кристаллогидраты
·
Авторский алгоритм задач на растворы
Σധ
·
Определение Σധ
·
Определение
компонента системы по Σധ
·
Правило креста
·
Сравнение алгоритма
Σധ и правила креста
·
Реакции в растворах
·
Задачи на олеум
·
Растворимость
·
Комбинированные
задачи с растворами
·
Коллоидные системы
Авторский алгоритм задач на растворы
Авторский
универсальный алгоритм решения задач на растворы имеет рабочее
название "Конечная омега Σധ" (массовая доля конечного
раствора).
Все задачи, так или иначе связанные с
растворами, решаются именно по такому алгоритму (хотя имеют
незначительные особенности).
Представленный алгоритм подразумевает
построение серьезной системы анализа, поэтому использовать его лучше при
решении сложных или комбинированных задач.
Особенности авторского
алгоритма "Σധ"
1. После написания данных в разделе "Дано"
необходимо нарисовать рисунок-схему. Это - обязательная составляющая
алгоритма (!), поскольку можно легко визуализировать все источники,
связанные с изменением массы вещества и массы раствора.
2. Основа алгоритма -
алгебраическая формула (1-я строка)
ധ(вещества) = m(вещества)/m(раствора)
3. Анализ числителя -
изменение массы вещества (2-я строка). Учитываются все источники
поступления вещества (вот для чего нужен рисунок). Над строкой анализа
делаем отступ для записи арифметических расчетов. На фото анализ записан
черным цветом, арифметические расчеты - красным.
4. Анализ знаменателя -
изменение массы раствора (3-я строка). Учитываются массы всех веществ,
которые поступили в систему или покинули ее (без рисунка сложно учесть
все изменения). Над строкой анализа делаем отступ для записи
арифметических расчетов. На фото анализ записан черным цветом,
арифметические расчеты - красным.
5. Проводим анализ каждой составляющей
алгебраических выражений во 2-й и в 3-й строках. На основании данных
условия задачи делаем расчеты и записываем их результаты над строками
анализа.
6. Арифметические данные записываем в
отдельное алгебраическое выражение и делаем окончательный расчет.
Задача
Какой объем раствора сульфата меди (II)
с массовой долей 5% и плотностью 1,05 г/мл нужно взять для растворения
75 г медного купороса, чтобы получить раствор с массовой долей сульфата
меди (II) 0,2?
_1.jpg)
Анализ алгоритма
1. После написания данных в разделе "Дано"
необходимо нарисовать рисунок-схему для визуализации всех источников,
связанных с изменением массы вещества и массы раствора
2. Основа алгоритма - формула ധ(в) = m(в)/m(р)
3. Анализ числителя (массы вещества в
конечном растворе). Вещество в конечном растворе появилось из двух
источников - исходный раствор и кристаллогидрат
4. Анализ знаменателя (массы конечного
раствора). Масса конечного раствора сложилась из двух источников - массы
исходного раствора соли и массы кристаллогидрата
5. По условию задачи необходимо найти объем
исходного раствора соли, рекомендуется определить ее в качестве
неизвестного Х
6. Для каждой составляющей системы (исходный
раствор соли и кристаллогидрат) следует записать отдельное "досье", в
которых выполняются необходимые расчеты
7. Результаты расчетов (из "досье") следует
записать над строками анализа и выписать их в отдельное алгебраическое
выражение (в конкретном случае - алгебраическое уравнение), решение
которого является ответом задачи.

Задачи на закрепление алгоритма
Задача
1
В
712,2 мл 5%-го раствора соляной кислоты (р
= 1,025 г/мл) растворили 33,6 л
хлороводорода (н.у.). Чему равна
массовая доля хлороводорода в
полученном растворе?
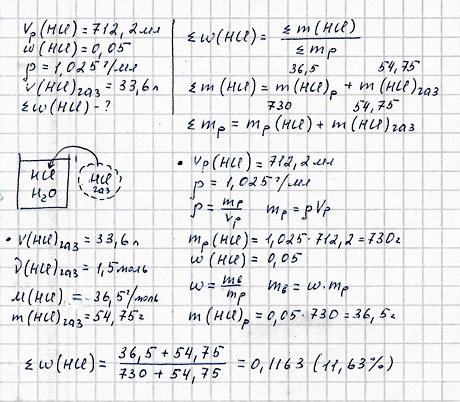
Задача
2
Из
180 мл 25%-го раствора вещества (ρ = 1,1 г/мл)
выпарили 20 мл воды. Определите
массовую долю вещества во вновь
полученном растворе


Задачи для самостоятельного решения
1. В 712,2 мл 5%-го раствора соляной кислоты
(ρ = 1,025 г/мл) растворили 33,6 л хлороводорода (н.у.). Чему равна
массовая доля хлороводорода в полученном растворе? (11,6%)
2. В 120 мл (ρ = 1,2 г/мл) 15%-го раствора
хлорида натрия растворили еще 12 г этого же вещества. Определите
массовую долю поваренной соли во вновь полученном растворе (21,5%)
3. Слили два раствора гидрокарбоната натрия:
160 г 15%-го и 140 г 12%-го. Определите массовую долю соли в
образовавшемся растворе (13,6 %)
4. В 250 г 5%-го раствора сульфата меди (II)
растворили еще 125 г медного купороса. Определите массовую долю соли во
вновь полученном растворе (24,66%)
5. Определить массовую долю сульфата железа
(II) в растворе, полученном при смешивании 200 мл 70%-ного раствора
FeSO4 (ρ = 1,6 г/мл) и 300 мл 25%-ного раствора FeSO4 (ρ = 1,18 г/мл)
(46,4%)
6. Определить массовую долю сульфата меди в
растворе, полученном при растворении 50 г медного купороса в 450 г воды
(6,4%)
7. Определите массовую долю сульфата натрия
в растворе, полученном при растворении 40 г глауберовой соли в 200 г
раствора сульфата натрия с массовой долей соли 0,2 (24%)
8. Смешали 200 мл 20%-ного раствора (ρ =
1,05 г/мл) и 300 мл 1,5М (ρ = 1,1 г/мл) раствора гидроксида кальция с
250 мл воды. Определить массовую долю образовавшегося раствора (9,53%)
9. Определите массовую долю хлорида меди (II)
в растворе, полученным при растворении 17,1 г дигидрата хлорида меди (II)
в 33,3 г раствора хлорида меди (II) с массовой долей соли 20% (40%)
10. Определите массовую долю хлорида бария в
растворе, полученным при растворении 177,8 г дигидрата хлорида бария в
400 г раствора хлорида бария с массовой долей соли 20% (40%)
11. Определите массовую долю хлорида кальция
в растворе, полученным при растворении 98,7 г гексагидрата хлорида
кальция в 200 мл раствора хлорида кальция (ρ = 1,01 г/мл) с массовой
долей соли 5% (20%)
12. Определите массовую долю нитрата кальция
в растворе, полученным при растворении 146 г тетрагадрата нитрата
кальция в 200 г раствора нитрата кальция с массовой долей соли 15% (38%)
13. Какую массу тетрагадрата нитрата кальция
необходимо добавить к 200 г раствора нитрата кальция с массовой долей
соли 0,15, чтобы получить раствор с массовой долей 38%? (146 г)
14. Определите массу раствора хлорида меди (II)
с массовой долей соли 0,2, к которому необходимо добавить 17,1 г
дигидрата хлорида меди (II), чтобы приготовить раствор с массовой долей
соли 0,4 ( 33,3 г)
15. Определите массу дигидрата хлорида
бария, которую необходимо растворить в 400 г раствора хлорида бария с
массовой долей соли 0,2, для получения раствора с массовой долей соли
0,4 (177,8 г)
16. Определите массу гептагидрата сульфата
железа (II), которую необходимо растворить в 400 г воды, чтобы получить
раствор соли с массовой долей вещества 4% (31,6 г)
17. В каком объеме воды растворили 50 г
пентагидрата сульфата меди (II), если получили 4%-ный раствор соли? (750
мл)
18. Определите объем воды, в котором
необходимо растворить 6,44 г глауберовой соли, чтобы получить раствор
сульфата натрия с массовой долей 15% (12,5 мл)
19. В каком объеме воды необходимо
растворить 7 г железного купороса, чтобы получить раствор сульфата
железа (II) с массовой долей соли 0,2? (12 мл)
20. Определите объем хлороводорода, который
нужно растворить в 365 г 5%-й соляной кислоты, чтобы получить 15%-й
раствор (26,35 л)
21. Вычислите массу гептагидрата сульфата
магния, который следует растворить в 69 г воды для получения 15%-го
раствора соли (31 г)
22. Определить массу кристаллической соды,
которую следует растворить в 321 г воды для приготовления 15%-ного
раствора карбоната натрия (219 г)
23. Определите массу глауберовой соли,
которую следует взять для приготовления 140 мл 20%-го раствора сульфата
натрия с плотностью 1,085 г/мл (69 г)
24. Определите массу глауберовой соли,
которую необходимо растворить в 800 г воды для приготовления раствора
соли с массовой долей 10% (235,3 г)

|